- Accueil›
- Actualités›
- Comment Enregistrer des Produits Vétérinaires Étrangers en Égypte
Comment Enregistrer des Produits Vétérinaires Étrangers en Égypte


Aperçu du Contenu
Catégories D'Enregistrements de Produits Vétérinaires en Égypte

- Additifs pour Aliments ou Compléments Nutritionnels
- Médicaments Vétérinaires
- Désinfectants Vétérinaires
- Vaccins Vétérinaires
Exigences D'Enregistrement pour les Additifs Alimentaires/Compléments Nutritionnels Vétérinaires en Égypte

Bien qu'il suive les mêmes lignes directrices et processus généraux que les produits pharmaceutiques vétérinaires, il implique souvent moins de documents techniques. La ligne directrice détaillée pour l'enregistrement des additifs alimentaires ou des compléments nutritionnels vétérinaires en Égypte peut être trouvée ici: Le processus garantit que tous les produits répondent aux normes de sécurité, de qualité et de nutrition pour la consommation animale.
1. Soumission du Dossier:
Le processus commence par la présentation d'un dossier contenant les éléments suivants:
- Composition du Produit: Informations détaillées sur les ingrédients, y compris les composants actifs, les excipients et leurs sources.
- Processus de Fabrication: Description complète de la production de l'additif alimentaire ou du supplément, y compris les points de contrôle qualité et les protocoles de sécurité.
- Données d'Efficacité Nutritionnelle: Documentation prouvant l'efficacité du produit pour améliorer la santé ou la nutrition animale.
- Données de Sécurité: Études et analyses prouvant que le produit est sûr pour la consommation animale, y compris les effets secondaires potentiels ou les niveaux de toxicité.
- Certificat de Libre Vente (FSC): Vérification que le produit est légalement vendu dans son pays d'origine.
- Certificat Non-OGM: Si applicable, ce certificat garantit que le produit ne contient pas d'organismes génétiquement modifiés.
Les échantillons du produit doivent être soumis au Laboratoire Central pour les Aliments et Additifs Animaux pour des tests approfondis. Les tests de laboratoire visent à vérifier que le produit est conforme aux normes égyptiennes pour les aliments pour animaux, garantissant qu'il est sûr et bénéfique pour la consommation animale.
Les tests réalisés peuvent inclure:
- Analyse Nutritionnelle: Assurer que le produit apporte les bienfaits nutritionnels revendiqués.
- Test de Contaminants: Vérification de la présence de substances nocives telles que les métaux lourds, les pesticides ou les contaminants microbiens dangereux.
Le MOA exige que tous les additifs alimentaires et suppléments répondent à des normes strictes d'emballage et d'étiquetage. Les étiquettes doivent inclure:
- Détails de la Composition: Liste de tous les ingrédients et leurs quantités.
- Instructions d'Utilisation: Indications claires sur la façon dont le produit doit être administré ou mélangé avec les aliments pour animaux.
- Avertissements de Sécurité: Toute précaution ou risque associé à l'utilisation du produit.
- Allégations Nutritionnelles: Les allégations concernant les avantages du produit doivent être étayées par des preuves scientifiques.
- Après des tests réussis et la révision du dossier, le MOA délivrera un Certificat d'Enregistrement pour l'additif ou le supplément, permettant sa vente et sa distribution en Égypte.
- Ce certificat est généralement valable pour 5 à 10 ans, selon le type de produit, après quoi un renouvellement est requis.
Délais Estimés: Le processus prend généralement de 6 à 9 mois, selon la préparation du dossier et le temps requis pour les tests en laboratoire.
SIMPLIFIER L'ENREGISTREMENT
Exigences D'Enregistrement pour les Médicaments Vétérinaires en Égypte

L'enregistrement des médicaments vétérinaires en Égypte suit un processus structuré et en plusieurs étapes visant à garantir la sécurité, l'efficacité et la conformité avec les Bonnes Pratiques de Fabrication (GMP). Voici les étapes détaillées :
1. Exigences Pré-enregistrement:
- Le demandeur (généralement un fabricant ou un distributeur local) doit avoir un compte enregistré auprès de l'Autorité Égyptienne des Médicaments (EDA).
- Tous les sites de fabrication doivent être conformes aux normes GMP et disposer de la documentation appropriée pour prouver leur conformité.
2. Soumission du Dossier:
- Fichier Maître du Site (SMF) : Ce document fournit des informations complètes sur l'installation de fabrication, y compris le personnel, l'équipement, la disposition et les mesures de contrôle de la qualité.
- Certificat de Bonnes Pratiques de Fabrication (GMP): Un certificat valide délivré par une autorité reconnue confirmant que le site de fabrication répond aux normes GMP.
- Informations sur le Produit: Une description détaillée de la composition du produit, des ingrédients actifs, des excipients et de la méthode de fabrication. Cela doit également inclure des Données Pharmacologiques, des Données de Stabilité, l'Efficacité Clinique, des Études de Toxicité, et des Protocoles de Contrôle Qualité.
- Certificats tels que le Certificat de Libre Vente (FSC) et le Certificat de Produit Pharmaceutique (CPP).
3. Examen Scientifique et Administratif:
- Le dossier est examiné par le comité scientifique de l'EDA. Ils évalueront la sécurité, l'efficacité, les mesures de contrôle de la qualité du produit et sa conformité aux normes locales et internationales.
- Le processus peut inclure des demandes d'informations supplémentaires ou des clarifications, en fonction de la complexité du produit et de l'intégralité du dossier.
4. Soumission et Analyse des Échantillons:
- Des échantillons du produit doivent être soumis à un laboratoire approuvé par l'EDA pour analyse. Les tests de laboratoire visent à s'assurer que le produit répond aux spécifications fournies dans le dossier, y compris la puissance, la pureté et la stabilité du produit.
- Les résultats de cette analyse contribueront à la décision finale d'approbation du produit.
5. Approbation et Délivrance du Certificat d'Enregistrement:
- Si l'EDA est satisfaite du dossier et des résultats des tests de laboratoire, elle délivrera un Certificat d'Enregistrement de Produit Vétérinaire, permettant la commercialisation et la distribution du produit en Égypte.
- Le certificat d'enregistrement est généralement valable pendant 10 ans, après quoi un renouvellement est nécessaire.
Délais Estimés: Le processus complet prend généralement entre 6 et 12 mois, selon la complexité du produit et la complétude de la soumission initiale du dossier.
RATIONALISER L'ENREGISTREMENT
Exigences D'Enregistrement pour les Désinfectants Vétérinaires en Égypte

Ce processus garantit que tous les désinfectants répondent aux normes de sécurité et d'efficacité pour la santé animale et humaine. La ligne directrice détaillée de l'enregistrement des désinfectants vétérinaires en Égypte peut être trouvée ici : 1. Soumission du Dossier :
Les documents requis incluent :
- Composition du Produit : Formule détaillée et ingrédients actifs.
- Processus de Fabrication : Description complète du processus de production.
Le dossier d'enregistrement doit être téléchargé sur la plateforme en ligne de l'EDA, accompagné des frais et des documents requis.
2. Étiquetage et Emballage :
Les étiquettes doivent être conformes aux normes égyptiennes, spécifiant les instructions d'utilisation, les avertissements de sécurité et la liste des ingrédients en arabe et dans toute autre langue requise.
3. Test des Échantillons :
Des échantillons du désinfectant doivent être soumis à des tests de laboratoire pour garantir qu'ils répondent aux normes de sécurité et d'efficacité. Les désinfectants doivent prouver leur efficacité contre les microorganismes ciblés et répondre à toutes les exigences réglementaires pour les environnements vétérinaires.
4. Approbation :
La demande est examinée par un comité spécialisé. Après une évaluation réussie, le produit reçoit une Licence d'Enregistrement, valable 10 ans.
5. Approbation Préliminaire pour les Nouveaux Produits :
Une approbation préliminaire est délivrée pour les nouveaux produits, permettant aux fabricants de produire et de tester des lots localement sous des conditions contrôlées. Pour les produits importés, des études de stabilité et des échantillons doivent être soumis pour vérification.
6. Renouvellement et Extension :
Les produits doivent être réenregistrés avant l'expiration des 10 ans. Le réenregistrement est requis tous les 10 ans, avec des données supplémentaires de stabilité et éventuellement des tests d'échantillons pendant la réenregistrement. Si un délai supplémentaire est nécessaire pour compléter les exigences, une extension peut être accordée.
Considérations Clés pour l'Enregistrement des Désinfectants
- Données de Toxicité : Les désinfectants doivent fournir des rapports de toxicité complets pour démontrer une utilisation sûre dans les environnements vétérinaires.
- Impact Environnemental : Si applicable, les effets potentiels du produit sur l'environnement, tels que la toxicité résiduelle, doivent être évalués.
Exigences D'Enregistrement pour les Vaccins Vétérinaires en Égypte
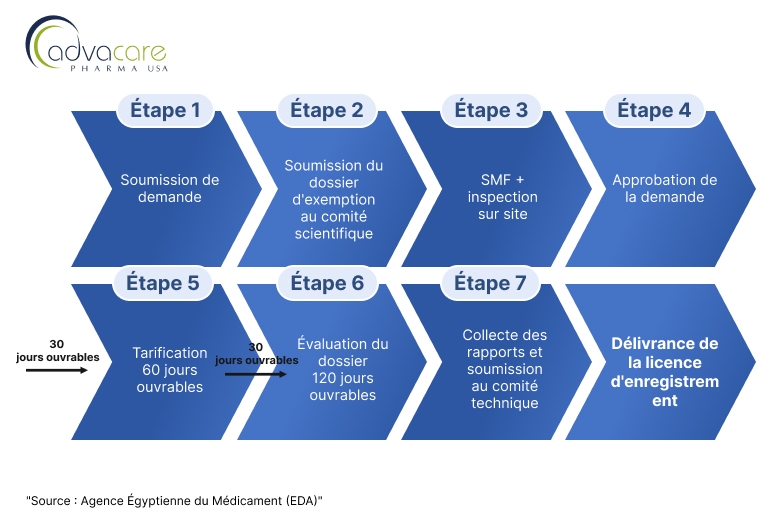
Les distributeurs cherchant à enregistrer des produits vaccinaux vétérinaires étrangers finis, en particulier ceux provenant de pays non référents, peuvent suivre les étapes décrites dans le Processus B de l'article résumé par le diagramme de flux suivant :
1. Soumission de la Demande d'Enquête
Le demandeur soumet une demande d'enquête pour approbation. Le demandeur 201 devra contacter l'unité d'examen des dossiers scientifiques pour soumettre un dossier d'exemption dans un délai de 20 jours ouvrables, faute de quoi la demande sera annulée.
2. Soumission des Documents du Site et Inspection sur Place :
Après l'approbation du comité scientifique spécialisé pour les produits biologiques, le demandeur doit soumettre le dossier maître du site (SMF) pour être évalué par le département d'inspection biologique. En cas d'approbation du SMF soumis, le département d'inspection inspectera le site pour vérifier sa conformité aux GMP. Les inspecteurs évalueront si le site adhère aux normes GMP et aux réglementations locales égyptiennes.
3. Soumission du Dossier :
Après approbation de la conformité GMP du site de fabrication, le demandeur doit soumettre un dossier complet. Le dossier doit inclure :
- Composition du Produit : Informations détaillées sur les ingrédients actifs et inactifs du vaccin.
- Processus de Fabrication : Un aperçu clair du processus de fabrication, y compris des détails sur les matières premières et les mesures de contrôle qualité.
- Données de Stabilité : Études de stabilité prouvant que le vaccin maintient son efficacité tout au long de sa durée de vie.
- Données de Sécurité et d'Efficacité : Résultats des essais cliniques, souvent y compris des études locales pour prouver que le vaccin est efficace et sûr dans les populations animales en Égypte.
- Certification GMP : Certificat du site de fabrication du vaccin prouvant la conformité aux Bonnes Pratiques de Fabrication (GMP).
- Certificat de Libre Vente (FSC) ou équivalent, prouvant que le vaccin est approuvé pour la vente dans son pays d'origine.
- Les échantillons du vaccin doivent être soumis à un laboratoire approuvé pour des tests de contrôle qualité. Les tests vérifient généralement la puissance, la sécurité et la conformité du vaccin aux spécifications du dossier.
- Les vaccins peuvent être soumis à des essais d'efficacité locaux si le MOA l'exige pour démontrer leur efficacité dans les conditions locales.
- L'étiquetage et l'emballage doivent être conformes aux réglementations égyptiennes. Cela inclut de s'assurer que l'étiquette contient les instructions appropriées, les avertissements et les informations sur les lots en arabe et dans d'autres langues requises.
- Après l'examen réussi du dossier et les tests de laboratoire, GAVS délivrera un Certificat d'Enregistrement de Vaccin, permettant la commercialisation et la vente du vaccin en Égypte.
- Le certificat d'enregistrement doit généralement être renouvelé périodiquement, avec un renouvellement nécessitant souvent des données de stabilité mises à jour et éventuellement de nouveaux tests d'échantillons.
- Le processus peut prendre de 9 à 12 mois, en fonction de la complexité du vaccin, de la complétude du dossier et des tests ou inspections de site requis.
ENREGISTREMENT ACCÉLÉRÉ
Simplifier Le Processus D'Enregistrement Avec AdvaCare Pharma

Passer par le processus complexe d'enregistrement de produits vétérinaires étrangers en Égypte nécessite une compréhension approfondie des réglementations spécifiques de chaque pays, depuis la soumission du dossier jusqu'aux tests locaux et à la surveillance post-commercialisation. S'associer à une entreprise expérimentée comme AdvaCare Pharma, qui possède une expertise étendue dans la région, garantit un processus d'enregistrement plus fluide et plus efficace. Avec nos connaissances et services personnalisés, nous vous aidons à surmonter les défis réglementaires et à enregistrer avec succès vos produits vétérinaires à travers le Moyen-Orient.
Il est essentiel pour les distributeurs de travailler avec des fabricants capables de fournir un support technique optimal dans ce processus hautement complexe.
Comment Facilitons-Nous Les Enregistrements ?
- Préparation et Authentification des Documents Rationalisées AdvaCare Pharma s'assure que tous les documents du site, y compris le Fichier Maître du Site (SMF) et les certificats GMP, sont constamment mis à jour et prêts à être soumis. Cela permet un démarrage rapide du processus d'enregistrement du site. Nous priorisons le processus d'authentification et, avec la confirmation du distributeur, nous veillons à ce que les documents corrects soient légalisés immédiatement, minimisant ainsi les retards et évitant les coûts inutiles dus à la mauvaise gestion des documents.
- Expérience dans les Revues GMP et Inspections de Site AdvaCare Pharma a passé avec succès de nombreuses revues GMP et inspections de site à travers la région, répondant aux normes élevées attendues par les autorités locales. Nos installations de production maintiennent des mesures de contrôle qualité rigoureuses, garantissant la conformité aux exigences réglementaires. De la facilitation des demandes de visa à l'accompagnement des inspecteurs lors des visites sur site, AdvaCare Pharma gère efficacement tout le processus d'inspection, offrant une expérience fluide aux distributeurs et aux inspecteurs.
- Soumission de Dossiers Complète et de Haute Qualité Chez AdvaCare Pharma, nous priorisons la qualité et la conformité dans chaque soumission de dossier. Notre équipe technique expérimentée veille à ce que chaque dossier soit adapté aux exigences spécifiques du pays où l'enregistrement est déposé. En rassemblant minutieusement toutes les références internes et externes nécessaires avant de commencer le processus d'enregistrement, nous minimisons les chances de demandes supplémentaires ou de rejets des autorités locales, rendant ainsi le processus de révision plus fluide et plus rapide.
- Emballage Personnalisé et Qualité des Échantillons L'emballage est un élément crucial dans l'enregistrement des produits, et AdvaCare Pharma va au-delà pour s'assurer qu'il respecte les normes locales. Nous collaborons étroitement avec nos distributeurs pour concevoir et produire des illustrations d'emballage conformes aux réglementations locales. Nos échantillons sont fabriqués conformément aux exigences d'enregistrement pour garantir la plus haute qualité, en adéquation avec les exigences strictes de test et d'évaluation de chaque pays. Cette approche garantit que nos produits respectent toutes les normes locales, facilitant ainsi un processus d'enregistrement réussi et efficace.
En savoir plus sur notre processus d'enregistrement en 7 étapes >>
AdvaCare Pharma comprend les complexités de la navigation dans les exigences rigoureuses d'enregistrement pour les produits vétérinaires. Avec plusieurs produits déjà enregistrés dans la région du CCG et dans plus de 65 pays à travers le monde, nous offrons un chemin simplifié et fiable vers le succès sur le marché. Notre engagement envers l'excellence réglementaire, combiné à un support personnalisé et à des solutions d'emballage, garantit que votre processus d'enregistrement soit fluide et efficace.
Rejoignez notre réseau mondial de distributeurs de confiance dès aujourd'hui. En tant que partenaire d'AdvaCare Pharma, les distributeurs bénéficieront d'une assistance réglementaire et technique complète, garantissant un accès plus rapide au marché pour des produits de haute qualité et abordables. Nous offrons également des avantages exclusifs aux distributeurs, y compris un soutien marketing complet, des formations sur les produits et des ressources de vente pour aider à développer votre entreprise. Avec un engagement envers des partenariats solides, nous sommes dévoués à votre succès à long terme. Visitez notre site web et postulez pour devenir distributeur afin d'obtenir un avantage concurrentiel dans votre région.
Références : EDA 2024 "EDA" EDA 2023 "Lignes directrices sur les procédures d'enregistrement des produits pharmaceutiques vétérinaires" EDA 2023 "Lignes directrices et règles commerciales pour l'enregistrement des antiseptiques/desinfectants" EDA 2023 "Lignes directrices pour l'enregistrement des produits biosimilaires en Égypte" MEVMAS 2024 "Conférence sur la Médecine Vétérinaire et les Sciences Animales du Moyen-Orient"
Vous ne voulez pas manquer le prochain article d'AdvaCare ?

Contenu recommandé

Étiquette Blanche vs Marque Privée vs Distribution : Qu’est-Ce Qui Est Mieux Pour Les Entreprises De Compléments ?


Processus de Fabrication de Suppléments


Comment Enregistrer des Produits Vétérinaires Étrangers au Moyen-Orient
